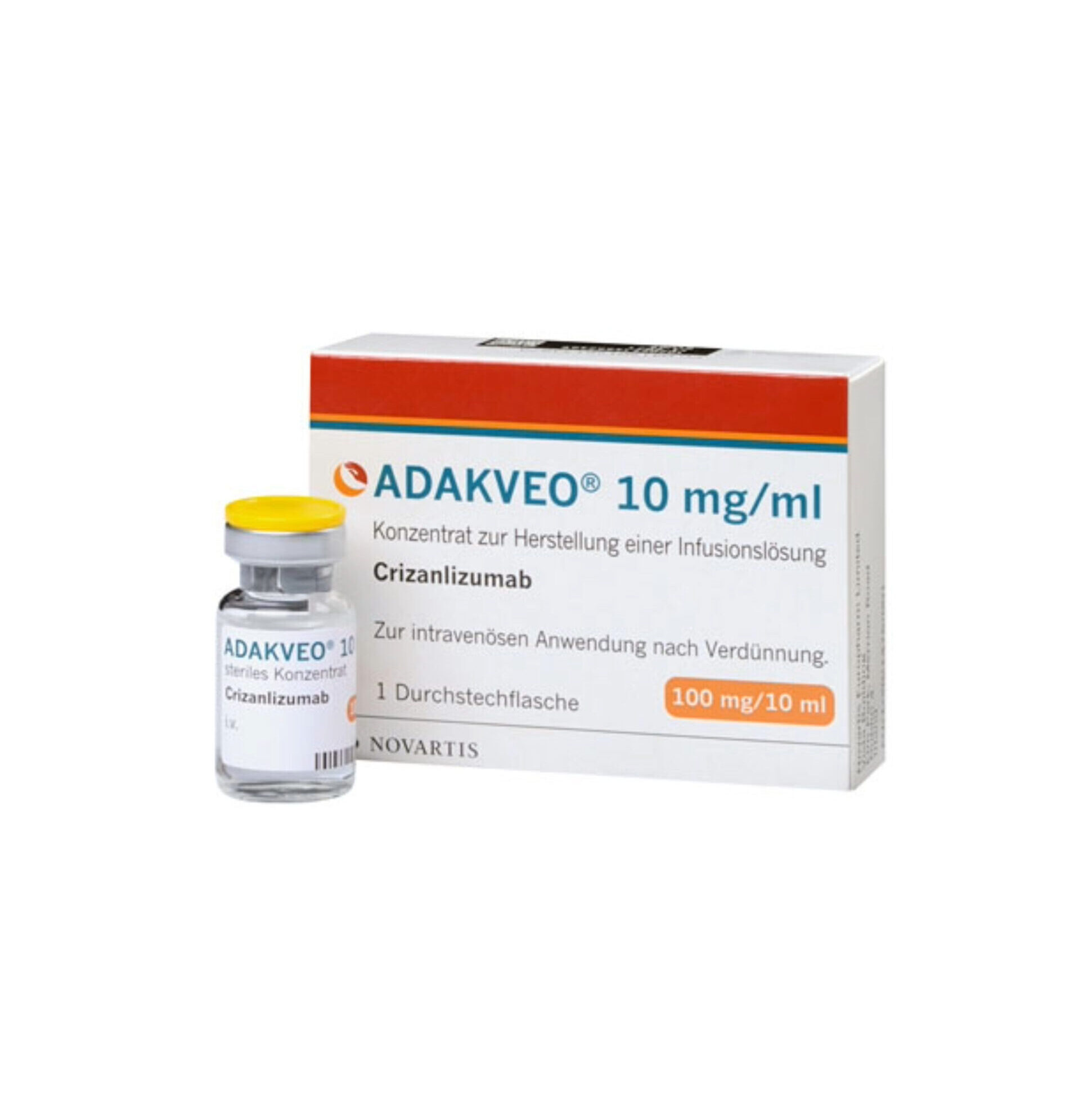
El Adakveo (Crizanlizumab) es un bloqueador de la selectina indicado para reducir la frecuencia de las crisis vaso-oclusivas (COV), o crisis de dolor, en pacientes mayores de 16 años con anemia drepanocítica.
El medicamento puede utilizarse como tratamiento complementario de la hidroxicarbamida (también conocida como hidroxiurea) o por sí solo en pacientes que no responden lo suficientemente bien a la hidroxicarbamida o cuando ésta causa demasiados efectos secundarios .
Está disponible en forma de solución que contiene 100 mg/10 mL de crizanlizumab por vial.
La ECM es una enfermedad genética que afecta la forma de los glóbulos rojos. Los glóbulos rojos sanos son redondos y son capaces de llevar oxígeno a todas las partes del cuerpo. En los pacientes con ECM, los glóbulos rojos tienen forma de hoz, lo que hace que se vuelvan duros y pegajosos. Como resultado, pueden atascarse y obstruir el flujo sanguíneo, causando crisis dolorosas y otros efectos graves.
Una proteína que está involucrada en los síntomas de la ECF es la P-selectina, una proteína que se encuentra en la superficie de las células endoteliales (las células que cubren las paredes internas de los vasos sanguíneos) y en las plaquetas (células sanguíneas que participan en la coagulación). La P-selectina hace que los glóbulos rojos falciformes se adhieran a los vasos sanguíneos, causando así COV.
El Crizanlizumab es un anticuerpo monoclonal, un tipo de proteína, que puede unirse a la P-selectina e inhibirla. Por lo tanto, puede ayudar a mantener el flujo sanguíneo normal y prevenir una crisis oclusiva vascular.
El Adakveo (Crizanlizumab) fue aprobado para la prevención de crisis dolorosas en pacientes con enfermedad de células troncales embrionarias (SCD) por:
La Administración de Alimentos y Medicamentos (FDA), el 15 de noviembre de 2019.
La Agencia Europea de Medicamentos (EMA), el 30 de octubre de 2020.
Es el primer medicamento aprobado por la FDA en la anemia drepanocítica que se une a la P-selectina, que juega un papel importante en los COV.
El Adakveo (Crizanlizumab) recibió la designación de “medicamento huérfano” de la EMA, que se otorga a los medicamentos para el tratamiento de enfermedades raras.
Por favor, tenga en cuenta que este medicamento puede haber sido aprobado en otras regiones que no sean las que hemos listado.
Si tiene alguna pregunta sobre su aprobación en un país específico, no dude en contactar con nuestro equipo de apoyo.