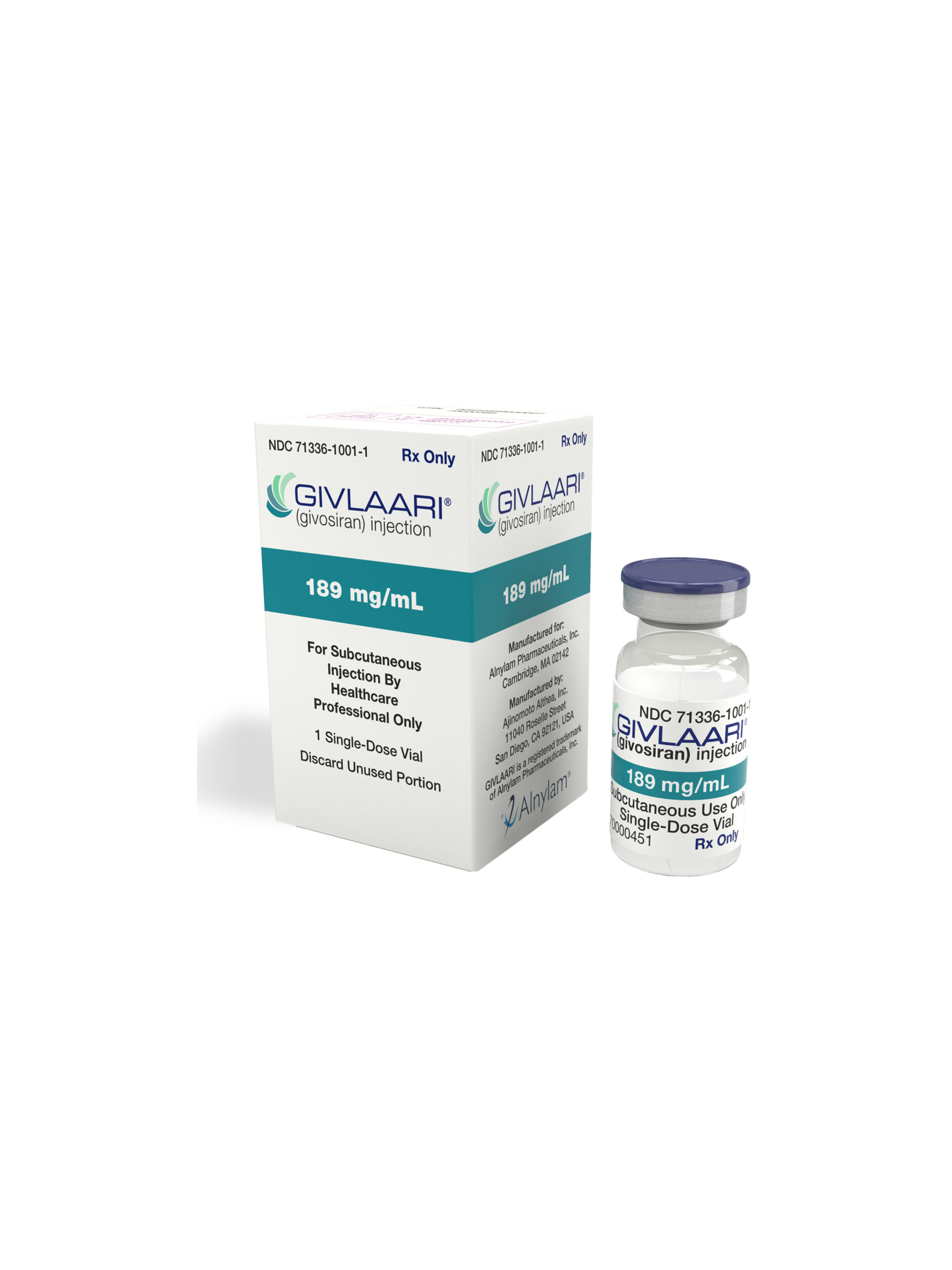
El givlaari (givosiran) es un pequeño ARN interferente (siRNA) dirigido por la aminolevulinato sintasa 1, indicado para el tratamiento de adultos y niños mayores de 12 años con porfiria hepática aguda (AHP).
Está disponible en un frasco de dosis única que contiene 189 mg/ml de givosiran.
La HPHA es un raro trastorno genético en el que una de las enzimas de la vía del hem no funciona correctamente. El hem juega un papel importante en el cuerpo, porque ayuda a unir y transportar el oxígeno en la sangre. La vía del hemo está controlada en el hígado por la enzima aminolevulinato sintasa 1 (ALAS1).
Ciertos desencadenantes pueden hacer que los niveles de ALAS1 aumenten, y esto a su vez provoca la acumulación de moléculas neurotóxicas llamadas ácido aminolevulínico (ALA) y porfobilinógeno (PBG). El ALA y el PBG causan daño a las células nerviosas, y por lo tanto causan los síntomas y los ataques (potencialmente mortales) de la AHP. El givosiran es un pequeño ARN de interferencia de doble cadena que reduce los niveles de ALA y PBG. Esto ayuda a proteger a los pacientes contra los ataques y otros síntomas de AHP.
Givlaari (givosiran) fue aprobado por:
La Administración de Alimentos y Medicamentos (FDA), EE.UU., el 20 de noviembre de 2019 para el tratamiento de los pacientes adultos con AHP.
La Agencia Europea de Medicamentos (EMA), el 31 de enero de 2020, para el tratamiento de adultos y niños de 12 años o más con AHP.
La FDA concedió a Givlaari (givosiran) la designación de Terapia de Revisión Prioritaria y de Ruptura. Givlaari también recibió la designación de Medicamento Huérfano por la FDA y la EMA, que tiene por objeto fomentar el desarrollo de tratamientos para enfermedades raras.